Введение
Глюкокортикоиды (син.: кортикостероиды, глюкокортикостероиды, далее – ГК) – класс препаратов, формирующий несколько групп анатомо-терапевтически химической (АТХ) классификации, одна из которых, H02AB, относится к кортикостероидам системного применения. В настоящий момент на уровне сотрудничающего центра по методологии лекарственной статистики ВОЗ (Осло, Норвегия) в группу включено 16 препаратов [1], однако, согласно обнаруженным литературным источникам, в терапии новой коронавирусной инфекции применяются три препарата: преднизолон, дексаметазон и метилпреднизолон (МП).
Являясь синтетическими аналогами гормона коры надпочечников кортизола и его активного метаболита кортизона, данные препараты оказывают противовоспалительное, противоаллергическое, десенсибилизирующее, противошоковое, антитоксическое и иммунодепрессивное действия. ГК взаимодействуют со специфическими цитоплазматическими рецепторами с образованием комплекса, проникающего в ядро клетки и стимулирующего синтез матричной рибонуклеиновой кислоты, которая индуцирует образование белков, в т.ч. липокортина и ядерных факторов, опосредующих клеточные эффекты. Липокортин угнетает фосфолипазу А2, подавляет высвобождение арахидоновой кислоты и синтез эндоперекисей, простагландинов, лейкотриенов, способствующих процессам воспаления, и др. [2–4]. Влияние на синтез ядерных факторов (nFκB, AP-1 и др.) опосредует другие эффекты ГК, в т.ч. изменение продукции интерлейкинов.
Цитокиновый шторм – каскадное неконтролируемое увеличение уровня цитокинов в крови, которое может приводить к избыточному иммунному ответу, повреждению органов и тканей [5]. Еще до 2020 г. установлено, что ГК способны подавлять цитокиновый шторм [6], а с 2020 г. данная группа получила широкое распространение в лечении пациентов с короновирусной инфекцией (COVID-19) для борьбы с цитокиновым штормом [7].
Целью данного обзора стало установление целесообразности использования системных ГК пациентами с тяжелым и критическим течением COVID-19. Мы не рассматривали исследования эффективности ГК для пациентов с легкой и средней степенями тяжести, а также исследования, в которых не анализировались данные подгрупп в зависимости от тяжести течения.
Клинические исследования глюкокортикоидов при COVID-19
Нами обнаружено несколько мета-анализов по применению ГК в отношении пациентов с тяжелым COVID-19. Целью первого исследования, опубликованного в сентябре 2020 г., стало изучение связи между приемом ГК и смертностью среди тяжелобольных пациентов с COVID-19 [11]. Данный мета-анализ лег в основу рекомендаций ВОЗ по использованию ГК в терапии COVID-19. В мета-анализ включили пациентов, принимавших системные дексаметазон, гидрокортизон или МП (n=678), и пациентов группы стандартного лечения или плацебо (n=1025). Первичным критерием оценки была смертность от всех причин через 28 дней после рандомизации. Вторичным критерием в анализе считали серьезные нежелательные явления. Средний возраст пациентов составил 60 лет (межквартильный размах, 52–68 лет), большинство пациентов были мужчинами – 1215 (71,3%). Риск систематической ошибки оценен как «низкий» для 6 из 7 включенных клинических исследований (КИ), к одному исследованию выдвинуты замечания из-за выбранного метода рандомизации. В пяти КИ сообщалось о величине смертности через 28 дней, в одном – через 21 и еще в одном – через 30 дней. Было зарегистрировано 222 случая смерти в группе ГК и 425 – в группе стандартной терапии или плацебо (отношение шансов [OR] = 0,66 (95% ДИ: 0,53–0,82; р<0,001). Анализ подгрупп обнаружил, что для дексаметазона (n=1282) по сравнению с обычным лечением или плацебо OR= 0,64 (95% ДИ: 0,50–0,82; р<0,001), для гидрокортизона (n=374) OR=0,69 (95% ДИ: 0,43–1,12; р=0,13), для МП (n=47) OR=0,91 (95% ДИ: 0,29–2,87; р=0,87). В 6 КИ, в которых сообщалось о развитии серьезных нежелательных явлений, 64 события произошли с 354 пациентами группы ГК и 80 – с 342 пациентами, рандомизированными в группы стандартного лечения или плацебо. В данном мета-анализе сделаны выводы, согласно которым для тяжелобольных пациентов с COVID-19 прием системных ГК по сравнению со стандартным лечением или плацебо был связан с более низкой (28-дневной) смертностью от всех причин [11].
В руководстве ВОЗ, в основе которого лежит указанный мета-анализ, приведены следующие результаты: различие в 28-дневной смертности для критических пациентов – 87 на 1000 пациентов (95% ДИ: 41–124), для тяжелобольных – 67 на 1000 пациентов (95% ДИ: 27–100), потребность в искусственной вентиляции легких (ИВЛ) – 30 на 1000 пациентов (95% ДИ: 8–48), для нетяжелых степеней заболевания различия не были статистически значимыми [15].
Второй мета-анализ проведен в конце 2020 г. и опубликован в феврале 2021 г. [12]. В нем также анализировались эффекты ГК у пациентов с COVID-19 разной степени тяжести. Исследователи провели поиск рандомизированных КИ взрослых пациентов с острой гипоксией, связанной с инфекцией SARS-CoV-2, получавших ГК, по сравнению с любыми другими вариантами терапии. Первичной конечной точкой послужил уровень смертности. Было включено пять КИ с участием 7692 пациентов. Смертность пациентов в группе ГК была незначительно, но статистически значимо ниже, чем в контрольной группе (26 против 28%, относительный риск (RR) = 0,89; 95% ДИ: 0,82–0,96; р=0,003). Такой же положительный эффект был обнаружен в подгруппе пациентов, которым требовалась ИВЛ (RR=0,85; 95% ДИ: 0,72–1,00; р=0,05; NNT=19). Примечательно, что ГК увеличивали смертность в подгруппе пациентов, не нуждавшихся в кислороде (17 против 13%, RR=1,23; 95% ДИ: 1,00–1,62; p=0,05; NNH=29). Анализ подгрупп (пациенты на ИВЛ и пациенты, не нуждавшиеся в кислороде) подтвердил, что лечение ГК имело статистически значимое различное влияние на выживаемость. Пациенты группы ГК имели значительно меньший риск перевода на ИВЛ. Исследователи сделали выводы о необходимости дальнейшего изучения проблемы: назначение ГК может быть рассмотрено в отношении тяжелых пациентов с COVID-19 в критическом состоянии, но их не следует рекомендовать пациентам, не нуждающимся в кислородотерапии [12].
Также опубликованный в феврале 2021 г. мета-анализ S. Ma et al. (7 КИ, 6250 пациентов с тяжелой формой COVID-19) подтвердил выводы предыдущих исследований: ГК снижают смертность пациентов вследствие разных причин (27,3 против 31,1%; RR=0,85; 95% ДИ: 0,73–0,99; р=0,04), предупреждают прогрессирование заболевания, например потребность в интубации, ИВЛ, ЭКМО, перевод в отделение интенсивной терапии (30,6 против 33,3%; RR=0,77; 95% ДИ: 0,64–0,92; р=0,005) и не увеличивают риск развития серьезных нежелательных явлений (3,5 против 3,4%; RR=1,16; 95% ДИ: 0,39–3,43; р=0,79). Важной находкой данного исследования является установление эффективности малых доз ГК (RR=0,85, 95% ДИ: 0,77–0,93) с продолжительностью терапии не менее 7 дней (RR=0,85; 95% ДИ: 0,78–0,92). Авторы справедливо заключают, что результаты их анализа, как и предыдущих, в большой степени зависят от результатов масштабного исследования RECOVERY, исключение которого из расчетов негативно влияет на результаты, делая их статистически незначимыми [18].
Уменьшение смертности пациентов с тяжелой формой COVID-19 (OR=0,65; 95% ДИ: 0,51–0,83; р=0,0006) продемонстрировано и при анализе подгруппы данных 8 рандомизированных КИ (n=1404). Следует отметить низкую гетерогенность данных (I2=29%; р= 0,19) в этом блоке мета-анализа, проведенного E.J. Cano et al. [22].
Негативное влияние ГК на смертность тяжелых и критически больных пациентов с COVID-19 обнаружено в систематическом обзоре Р. Budhathoki et al. (RR=2,01; 95% ДИ: 1,12–3,63). ГК не продемонстрировали влияния на частоту выписки (RR=0,79; 95% ДИ: 0,63–0,99) и не изменили прогрессирования заболевания (OR=0,24; 95% ДИ: 0,13–0,43). Как отмечают сами авторы, это может быть следствием как высокой гетерогенности включенных исследований разного качества, так и фактом 5-кратного преобладания ГК в схемах терапии пациентов в отделениях интенсивной терапии и др. [19].
В обзоре и мета-анализе J. van Paassen et al. (44 исследования, 20 197 пациентов) при анализе подгрупп пациентов со средней и тяжелой дыхательной недостаточностью такой эффект не подтвердился – общий риск составил 0,72 (95% ДИ: 0,57–0,87), хотя это исследование также отличала высокая степень гетерогенности включенных исследований [20].
Заслуживает большого внимания опубликованный в конце мая 2021 г. «зонтичный» мета-анализ 12 систематических обзоров, проведенный В. Cheng et al., в котором показано следующее: ГК у тяжело и критически больных COVID-19 уменьшают потребность в механической вентиляции на 27% (HR=0,73; 95% ДИ: 0,64–0,83) и уменьшают смертность на 20% (HR=0,80; 95% ДИ: 0,65–0,98), приводят к уменьшению времени пребывания в отделении реанимации и интенсивной терапии, но к увеличению продолжительности общей госпитализации и задержке времени элиминации вируса. В тексте работы авторы уделяют большое внимание анализу гетерогенности данных и критике уже опубликованных мета-анализов, призывают к интенсификации проведения КИ по данной проблеме и поддерживают назначение системных ГК критически больным пациентам [24].
Заслуживает упоминания и ряд КИ, посвященных изучению эффективности отдельных ГК.
Дексаметазон
Безусловно, основным КИ эффективности и безопасности использования дексаметазона пациентами с тяжелой формой COVID-19 остается исследование RECOVERY [8], описанное в других разделах данного обзора.
По данным регистра clinicaltrials.gov, в настоящее время зарегистрировано 69 КИ использования дексаметазона пациентами с COVID-19 (данные на 08.07.2021): в 34 КИ проводится активный набор участников, в 18 – набор еще не начат, 11 исследований завершено, из них по двум опубликованы первые результаты. Одно КИ связано с назначением ивермектина в сочетании с доксициклином для лечения симптомов COVID-19, а дексаметазон в обеих группах (основной и плацебо) выступает как обязательный препарат стандартной терапии. Во втором КИ изучались эффекты ивермектина, ацетилсалициловой кислоты, дексаметазона и эноксапарина при лечении COVID-19. В части опубликованных данных информации о дексаметазоне нет.
В феврале 2021 г. был обновлен предварительный отчет крупного рандомизированного открытого исследования RECOVERY (NCT04381936), проведенного в Великобритании [8]. В этом исследовании, сравнивавшем несколько возможных методов лечения пациентов, госпитализированных с COVID-19, случайным образом распределили в группу дексаметазона (пероральный или внутривенный путь введения, доза – 6 мг 1 раз в сутки до 10 дней, n=2104). Контрольная группа (n=4321) получала стандартную терапию без дексаметазона. В результате 482 (22,9%) пациента группы дексаметазона и 1110 (25,7%) контрольной группы умерли в течение 28 дней после рандомизации (скорректированный по возрасту коэффициент частоты – 0,83; 95% ДИ: 0,75–0,93; р<0,001). Различия в уровне смертности между группами значительно зависели от уровня респираторной поддержки, которую пациенты получали во время рандомизации. В группе дексаметазона частота летальных исходов была ниже, чем в контрольной группе, у пациентов, получавших инвазивную ИВЛ (29,3 против 41,4%; соотношение частот=0,64; 95% ДИ: 0,51–0,81) и среди пациентов, получавших кислород без инвазивной ИВЛ (23,3 против 26,2%; соотношение частот=0,82; 95% ДИ: 0,72–0,94), но не среди тех, кто не получал респираторной поддержки при рандомизации (17,8 против 14,0%; соотношение частот=1,19; 95% ДИ: 0,92–1,55). Предварительные выводы RECOVERY: у пациентов, госпитализированных с COVID-19, использование дексаметазона приводит к снижению 28-дневной смертности пациентов, находящихся на инвазивной механической вентиляции легких либо получающих только кислород, но не тех пациентов, которые не получают респираторной поддержки [8].
Преднизолон
По данным реестра clinicaltrials.gov, в настоящее время зарегистрировано четыре КИ эффективности преднизолона для пациентов с COVID-19 (данные на 08.07.2021). В двух исследованиях идет активный набор [NCT04657484, NCT04765371], одно КИ активно, но набор еще не начался [NCT03708718] и одно КИ [NCT04551781] завершено. Это рандомизированное контролируемое исследование по изучению эффективности низких доз ГК (20 мг преднизолона в течение 14 дней) в лечении инфильтратов легких после коронавируса, его результаты не опубликованы.
Метилпреднизолон
Одно из первых КИ, посвященных изучению эффективности МП для пациентов с тяжелым COVID-19, проведено с декабря 2019 по февраль 2020 г. в Ухани. У пациентов с острым респираторным дистресс-синдромом МП значимо уменьшил смертность (HR=0,38; 95% ДИ: 0,20–0,72) [21].
По данным clinicaltrials.gov, в настоящее время зарегистрировано 48 исследований, где упоминается введение МП пациентам с COVID-19 (данные на 08.07.2021): в 21 КИ проводится активный набор, в двух активного набора нет, 20 КИ завершено. Из завершенных КИ только для двух обнаружены опубликованные результаты.
Первое [NCT04323592] – это наблюдательное обсервационное когортное исследование эффективности низких доз МП для пациентов с тяжелой пневмонией, вызванной COVID-19 (n=173, из них в группе МП 83 пациента). Исследователи изучали связь между длительным воздействием низких доз МП и необходимостью направления в отделение интенсивной терапии, потребностью в интубации или смертью в течение 28 дней (комбинированная первичная конечная точка). Первичная конечная точка была достигнута 19 и 40 пациентами соответственно (скорректированное отношение рисков (aHR) =0,41; 95% ДИ: 0,24–0,72). Перевод в ОИТ и инвазивная механическая вентиляция потребовались 15 и 27 (р=0,07) пациентам и 14 и 26 (р=0,10) в группах МП по сравнению соответственно.
К 28-му дню в группе МП было меньше смертей (6 против 21; aHR=0,29; 95% ДИ: 0,12–0,73) и больше дней без инвазивной механической вентиляции (24,0±9,0 против 17,5±12,8; р=0,001). Частота осложнений была одинаковой для обеих групп (р=0,84) [17]. Заслуживает внимания схема дозирования МП в данном КИ: к стандартной терапии добавляли 80 мг МП и вводили внутривенно болюсно с последующей инфузией в 240 мл физиологического раствора со скоростью 10 мл/ч.
Инфузия продолжалась не менее 8 дней до достижения либо PaO2/FiO2 >350 мм рт.ст. либо концентрации C-реактивного белка (СРБ) <20 мг/л. Затем пациентов переводили на пероральный прием МП до тех пор, пока уровень СРБ не достигнет значений нормального диапазона ±20% и/или PaO2/FiO2 >400 или SatHbO2 ≥95%. Исследователи делают заключение: у пациентов с тяжелой пневмонией, ассоциированной с COVID-19, раннее назначение пролонгированного лечения МП связано со значительно меньшим риском смерти (71%) и уменьшением зависимости от аппарата ИВЛ. Лечение показало себя безопасным и не повлияло на клиренс вируса [9].
Цель второго опубликованного исследования [NCT04411667] состояла в том, чтобы проверить, может ли внутривенное введение иммуноглобулина уменьшить частоту респираторных осложнений COVID-19 (дыхательная недостаточность и необходимость в ИВЛ). МП являлся компонентом стандартной схемы и не учитывался при сравнении.
Сравнение глюкокортикостероидов с ингибиторами рецептора интерлейкина-6 или янус киназы
Нами было найдено одно рандомизированное КИ, сравнивавшее краткосрочную выживаемость пациентов с COVID-19 в критическом состоянии в зависимости от терапии тоцилизумабом (TCZ) или дексаметазоном [NCT04519385]. Обращает на себя внимание то, что на сайте clinicaltrials.gov нет указаний на публикацию результатов исследования, и то, что в исследовании, официально зарегистрированы 69 человек. Мы обнаружили одну публикацию результатов данного исследования на сайте NATURE [25] (в виде научного отчета – scientific report), в которой описывается включение уже 149 пациентов, соответствующих критериям включения и распределенных в 2 группы по 75 человек. При этом 28 (группа TCZ) и 12 (группа дексаметазона) пациентов умерли в первые 3 дня после включения, поэтому их данные были исключены из анализа. Таким образом КИ включило данные 109 пациентов, случайным образом распределенных на терапию TCZ (46 пациентов) или пульс-терапию дексаметазоном (63 пациента). Возраст, пол, соотношение нейтрофилов/лимфоцитов, концентрация D-димера, уровень ферритина и результаты компьютерной томографии грудной клетки были сопоставимыми между группами. Анализ выживаемости по Каплану–Мейеру показал лучшие результаты в группе дексаметазона по сравнению с группой TCZ (р=0,002), также эти пациенты меньше нуждались в вазопрессорах при поступлении (р<0,0001); на неинвазивной вентиляции по сравнению с пациентами на механической вентиляции (р<0,0001) их было больше, а симптом «матового стекла» на КТ грудной клетки (р<0,0001) по сравнению с теми, у кого есть консолидация, встречался чаще. Регрессионный анализ Кокса показал, что терапия TCZ (HR=2,162, 95% ДИ: 1,144–4,087, р<0,0001) по сравнению с группой дексаметазона, высокие значения соотношения нейтрофилов/лимфоцитов (HR=2,40; 95% ДИ: 1,351–4,185, р=0,003), низкое PaO2/FiO2 через 2 дня после лечения (HR=1,147; 95 % ДИ: 1,002–1,624, р<0,0001) независимо предсказывало более высокую вероятность смерти. Исследователи сделали вывод, согласно которому дексаметазон показал лучшую выживаемость при тяжелой форме COVID-19 по сравнению с TCZ [25].
Глюкокортикостероиды в национальных и международных клинических руководствах, руководствах экспертных сообществ
После опубликования 2 сентября 2020 г. первых результатов RECOVERY [8] ВОЗ разработала и представила руководство «Кортикостероиды в лечении COVID-19», в котором международным коллективом авторов на основании данных указанного в разделе 2 мета-анализа J. Sterne et al. [11], были даны две рекомендации. Первая: «Мы скорее рекомендуем использование системных ГК, чем их отсутствие, для лечения пациентов с тяжелой и критической формой COVID-19» (строгая рекомендация, основанная на доказательствах со средней степенью достоверности). Вторая: «Мы предлагаем не использовать ГК при лечении пациентов с нетяжелым COVID-19» (условная рекомендация, основанная на доказательствах с низкой степенью достоверности) [15]. В июне 2020 г. на сайте ВОЗ появилась страница ответов на вопросы об использовании дексаметазона в терапии COVID-19, которая затем была обновлена в октябре того же года. ВОЗ повторяет свои рекомендации об использовании и добавляет, что продолжительность терапии дексаметазоном должна составлять 7–10 дней при однократном приеме в день, и приводит эквивалентные 6 мг дексаметазона дозы других ГК (160 мг гидрокортизона [например, 50 мг каждые 8 часов или 100 мг каждые 12 часов], 40 мг преднизона, 32 мг МП [8 мг каждые 6 часов]) [16]. В опубликованном 6 июля 2021 г. руководстве ВОЗ «Therapeutics and COVID-19: living guideline» (версия 5) рекомендации по использованию ГК остались неизменными и повторяют сформулированные выше [23].
В 11-й версии Временных методических рекомендаций Министерства здравоохранения РФ по профилактике, диагностике и лечению новой коронавирусной инфекции (COVID-19) от 07.05.2021 указано, что ГК являются препаратом первого выбора для лечения больных первичным гемофагоцитарным лимфогистоцитозом (ГЛГ) и вторичным синдромом активации макрофагов (САМ)/ГЛГ, т.к. они влияют на все фазы воспаления, угнетают синтез широкого спектра провоспалительных медиаторов, увеличение концентрации которых при цитокиновом шторме ассоциируется с неблагоприятным прогнозом, риском развития острого респираторного дистресс-синдрома и сепсиса [7]. Не рекомендуется использовать ГК в лечении COVID-19 легкой и умеренной степеней тяжести, в т.ч. в амбулаторных условиях. Для терапии цитокинового шторма могут применяться различные схемы введения ГК: дексаметазон 8–20 мг/сут. внутривенно в зависимости от тяжести состояния пациента за 1–2 введения; МП в дозе 1 мг/кг внутривенно каждые 12 часов с постепенным снижением дозы на 20–25% каждые 1–2 суток в течение 3–4 суток, далее на 50% каждые 1–2 суток до полной отмены. При прогрессировании САМ (нарастание уровня ферритина, СРБ сыворотки крови, развитие двух-трехростковой цитопении) МП применяется по схеме 125 мг/введение внутривенно каждые 6–8 часов или дексаметазон 20 мг внутривенно в два введения в течение не менее 3 дней с последующим постепенным снижением дозы.
Снижение дозы МП или дексаметазона начинается при условии снижения уровня ферритина сыворотки крови не менее чем на 15%. Максимальная доза ГК применяется в течение 3–4 суток, а затем снижается при стабилизации состояния (купирование лихорадки, стабильное снижение уровня СРБ, ферритина, активности трансаминаз, лактатдегидрогеназы сыворотки крови) [7].
Национальный институт здоровья Великобритании разделяет свои рекомендации по использованию ГК на 4 уровня в зависимости от тяжести состояния больного (см. таблицу) [10].
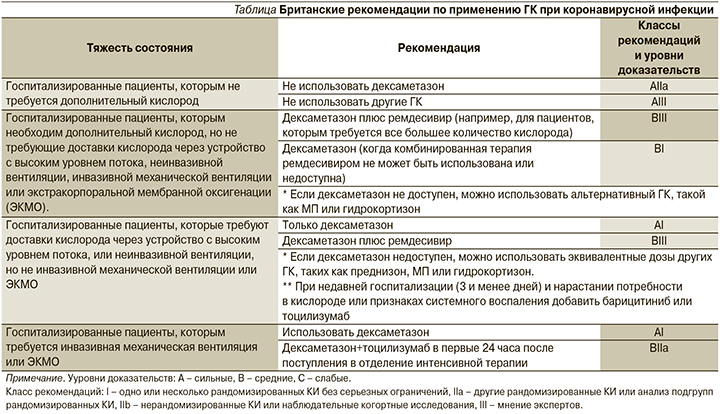
Согласно протоколам лечения пациентов с COVID-19 Brigham and Women’s Hospital, в отношении пациентов с COVID-19, находящихся в критическом состоянии или требующих дополнительной кислородотерапии, следует рассмотреть применение ГК в низкой дозе, длительность применения составляет 10 дней. Предлагаются следующие режимы: дексаметазон внутривенно или перорально по 6 мг/день; гидрокортизон 50 мг внутривенно каждые 8 чсов; МП 15 мг внутривенно 2 раза в день; преднизон 40 мг перорально [13].
В руководстве по лечению COVID-19 Massachusetts General Hospital дексаметазон рекомендован только для применения пациентами с тяжелым течением COVID-19 (пациенты, нуждающиеся в дополнительной кислородотерапии). А для пациентов со средней степенью тяжести или легким течением инфекции следует избегать применения любых ГК, за исключением применения по уже имеющимся показаниям [14]. Как альтернатива дексаметазону рекомендуется гидрокортизон внутривенно по 50 мг каждые 8 часов (или каждые 6 часов, если имеется рефрактерный шок) или МП внутривенно по 30 мг ежедневно, или преднизон per os по 40 мг каждый день [14].
Заключение
1. Системные ГК при использовании пациентами с тяжелой формой COVID-19 и критически больными пациентами, находящимися на кислородной поддержке, снижают смертность и предотвращают прогрессирование заболевания. Это доказано в систематических обзорах КИ и рекомендуется в руководствах ВОЗ, МЗ РФ, органов здравоохранения других государств.
2. Системные ГК следует рекомендовать только пациентам, находящимся на кислородной поддержке, и их не следует рекомендовать пациентам, не нуждающимся в кислородотерапии.
3. Нами обнаружено недостаточно исследований по сравнению ГК с ингибиторами рецептора ИЛ-6 или янус-киназы, чтобы говорить о превосходстве той или иной группы, но в отсутствие этих биологических препаратов, ГК могут рассматриваться как альтернатива для тяжелых пациентов на кислородной поддержке.
Дополнительная информация. Представленные рекомендации служат для поддержки клинических решений, принимаемых лечащим врачом, и не заменяют клинического мышления врача, самостоятельного поиска последней научной информации, сверку с действующими инструкциями по медицинскому применению лекарственных препаратов. Информация основана на результатах научного поиска, проведенного 08.07.2021 экспертами Центра «ФармаCOVID» на базе РМАНПО Минздрава России, Москва.


