Incidência de soroconversão em pacientes com diagnóstico laboratorial de SARS-CoV-2 (Covid-19)
Incidence of seroconversion in patients diagnosed with SARS-CoV-2 (Covid-19)
Maria Luiza Amorim Terciani1, Giovana Santa Rosa Santos1, Paula Munhoz de Barros1, Flávia Cristina Cardoso Carvalho2, Lourival Antunes de Oliveira-Filho1, Éric Diego Barioni1, Gustavo Henrique Oliveira da Rocha3, Beatriz Birelli do Nascimento2, Rômulo Tadeu Dias de Oliveira1
1 Universidade de Sorocaba, Faculdade de Biomedicina. Sorocaba, SP, Brasil.
2 Instituto de Diagnósticos de Sorocaba. Sorocaba, SP, Brasil.
3 Instituto Fraunhofer para Imunologia e Terapia Celular, Departamento de Desenvolvimento e Validação Pré-Clínica – Leipzig, Sachsen, Alemanha.
Recebido em 09/05/2023
Aprovado em 14/07/2023
DOI: 10.21877/2448-3877.202300121
INTRODUÇÃO
A Covid-19, doença viral causada por uma cepa de coronavírus descoberta em dezembro de 2019 na cidade de Wuhan, China,(1) é responsável por promover casos de síndrome respiratória aguda grave (SRAG), apresentando rápida disseminação e tornando-se pandêmica(2) e um grave problema de saúde pública mundial.(2,3) Até o dia 30 de março de 2023, foram confirmados 761.402.282 casos de Covid-19 no mundo,(4) sendo que, até a mesma data, o Brasil já somou mais de 37.145.514 casos confirmados e 699.634 óbitos.(5)
O agente etiológico é o coronavírus da síndrome respiratória aguda grave do tipo 2 (do inglês SARS-CoV-2), pertencente à família Coronaviridae.(3,6) A infecção pelo SARS-CoV-2 se inicia quando a glicoproteína Spike (S) se liga ao receptor da enzima conversora de angiotensina 2 (ECA2) na superfície da célula alvo e a protease serina transmembranar do tipo II, codificada pelo gene TMPRSS2 cliva a glicoproteína S, causando uma mudança conformacional na partícula viral e ocasionando a fusão com a membrana da célula.(7)
Dados epidemiológicos sugerem que o modo de transmissão mais comum para o SARS-CoV-2 ocorre por contato com gotículas expelidas durante a fala, tosse ou espirro, sendo também possível a propagação viral via gotículas de aerossol presentes em superfícies.(8) Os períodos de incubação do Covid-19 diferenciam-se de acordo com a variante correspondente, sendo 5 dias para Alpha, 4,5 dias para Beta, 4,41 dias para Delta e 3,42 dias para Ômicron, apresentando período médio de incubação de 6,57 dias.(9)
Pacientes sintomáticos de Covid-19 podem apresentar manifestações clínicas, que variam de brandas a críticas. Os sinais e sintomas são diferentes, dependendo do paciente, mostrando febre, fadiga, tosse, produção de escarro e falta de ar como os mais comuns.(8) Além disso, também foram observados sintomas menos comuns como dor de garganta, dor de cabeça, fraqueza, confusão e aperto no peito,(3,8) bem como náusea, vômitos, diarreia e complicação gastrointestinal.(8,10) Pacientes com comorbidades, como hipertensão, diabetes e doença cardíaca coronariana, apresentam risco substancialmente maior para desenvolver síndrome respiratória aguda grave.(11)
A resposta imunológica inicial ao SARS-CoV-2 é dependente do reconhecimento de estruturas virais, como proteínas do capsídeo e RNA viral, por receptores do tipo Toll (TLR) e receptores do tipo RIG no interior de células infectadas durante a replicação viral.(12) Com isso, são gerados fatores de transcrição que promovem a produção de mediadores inflamatórios como os interferons (IFN) do tipo I e II, genes estimulados por interferon, citocinas inflamatórias e quimiocinas, que desencadeiam a defesa antiviral inicial.(12,13) Linfócitos TCD4+ e TCD8+ são ativados, gerando resposta antiviral mais efetiva e específica. A resposta funcional de linfócitos TCD4+ foi identificada como uma resposta clássica T auxiliar 1 (TH1) contra a glicoproteína S, de membrana e de nucleocapsídeo,(14,15) além de mediar a produção de anticorpos pelas células B e aumentar a resposta efetora das células TCD8+ e natural killer (NK) durante a infecção viral. Essa cadeia de eventos promove a eliminação e resolução da doença na maior parte dos casos. Nos casos mais graves pode-se observar uma resposta hiperinflamatória com a presença de alterações laboratoriais importantes.(16)
Com isso, a identificação dos pacientes infectados pelo SARS-CoV-2, bem como dos pacientes que desenvolveram a memória imunológica, é essencial para impedir a disseminação da infecção viral, além de facilitar o acompanhamento da evolução da doença. Desta forma, o diagnóstico é composto pela história epidemiológica, quadro clínico e exames laboratoriais, como a reação em cadeia da polimerase com transcrição reversa em tempo real (RT-qPCR), detecção de antígenos e anticorpos por imunocromatografia, imunofluorescência, imunoabsorção enzimática e quimioluminescência.(17)
Dentre os testes laboratoriais, o RT-qPCR é considerado padrão ouro, pois permite a detecção de RNA viral em amostras de secreções de nasofaringe e orofaringe(18,19) com especificidade próxima de 100%.(20) A sensibilidade dessa técnica atinge o pico entre 4 a 5 dias após a infecção (92,7%) e permanece acima de 88% entre o 5º e o 14º dia,(20) variando segundo a dinâmica viral e o tipo de amostra que foi coletada (nasofaringe, escarro ou lavado bronco-alveolar).(21) O teste rápido de antígeno atualmente é uma excelente alternativa na rotina diagnóstica da infecção por SARS-CoV-2, pois é facilmente aplicável e com resultado rápido apresentando sensibilidade variável em pacientes assintomáticos (41,2%) versus sintomáticos (80,0%), em ambos os casos com alta especificidade (acima de 98,4%).(22)
Os testes sorológicos são utilizados para rastreamento populacional em busca da imunidade de rebanho e para inferir a probabilidade de uma nova infecção. De maneira geral, cerca de 40% a 50% dos indivíduos infectados produz anticorpos ao SARS-CoV-2 após 7 dias de infecção, enquanto a maioria os desenvolve em 14 dias.(23) Entretanto, estudo recente detectou anticorpos da classe IgM e IgG 5 dias após a infecção.(24,25) Outro estudo evidencia taxas de soroconversão para IgM e IgG de 82,7% e 64,7%, respectivamente, com tempo médio de 12 (IgM) e 14 dias (IgG) para que ocorra a soroconversão.(26) A utilização de testes sorológicos para triagem ou diagnóstico de infecção recente pode ocasionar resultados falsos negativos, devido ao período de janela imunológica para a produção de anticorpos, que pode variar de 5 a 15 dias, dependendo da concentração viral, genótipo viral, imunidade e características genéticas do indivíduo infectado.(19,25)
O entendimento da relação taxa de soroconversão de indivíduos expostos ao vírus versus exames para detecção de antígenos (RT-qPCR e imunocromatografia), ainda que já bastante explorado como descrito na literatura científica, pode ainda ser expandido pela avaliação de dados em populações específicas. Com isso, é objetivo deste trabalho avaliar a taxa de soroconversão de pacientes diagnosticados com SARS-CoV-2 e correlacioná-la com o tipo de teste diagnóstico utilizado.
MÉTODOS
Desenho do estudo
Foram analisados, de forma retrospectiva, os resultados provenientes de indivíduos que fizeram pesquisa para detecção de Covid-19 em um laboratório na cidade de Sorocaba – SP, que apresentavam exames de RT-qPCR e/ou teste rápido de antígeno para diagnóstico laboratorial de SARS-CoV-2 entre março de 2020 a fevereiro de 2021. Os resultados utilizados nas análises deste estudo são provenientes de indivíduos não vacinados, em que a soroconversão ocorreu por contato natural com o vírus SARS-COV-2. O projeto foi aprovado pelo Comitê de Ética em Pesquisas (CEP) sob número CAAE 47300621.0.0000.5500.
Procedimento
Para este levantamento, inicialmente os dados de 143 indivíduos foram analisados tendo como critérios para seleção teste de RT-qPCR e detecção de antígenos positivos. Os dados foram divididos em relação ao tipo de teste de swab e a sua positividade ou negatividade. Com isso, os resultados laboratoriais dos participantes foram utilizados para gerar uma tabela de dados omitindo sua identidade, para que a análise fosse realizada de forma cega pelos membros da pesquisa. Após a coleta dos dados, análises estatísticas específicas foram realizadas para correlacionar os dados obtidos.
Análises estatísticas
A análise estatística foi realizada por meio do programa GraphPad Prism 7®. A verificação da distribuição normal das variáveis quantitativas foi feita pelos testes de Kolmogorov-Smirnov e Shapiro-Wilk. As variáveis contínuas que não apresentaram distribuição normal foram expressas em mediana junto com intervalo de confiança da mediana e analisadas pelos testes U de Mann-Whitney para comparação de dois grupos independentes ou Kruskal-Wallis para análise de três ou mais grupos. Análises de variáveis categóricas foram avaliadas por teste exato de Fisher e por testes Qui-quadrado. Os resultados foram considerados estatisticamente significativos quando p<0,05.
RESULTADOS
Os dados utilizados para análise nesta pesquisa foram provenientes de testes para diagnóstico de Covid-19 em indivíduos submetidos aos exames de RT-qPCR e/ou teste rápido de antígeno para detecção do SARS-CoV-2. Dos 143 indivíduos testados, 56 pertenciam ao sexo feminino e 87 ao sexo masculino. Com relação à faixa etária, 55 indivíduos apresentaram idade entre 18 a 35 anos, 67 tinham idade entre 36 a 55 anos e 21 com idade acima de 56 anos. Dados provenientes de sujeitos com idade entre 0 e 17 anos foram descartados, uma vez que a resposta antigênica ao SARS-CoV-2 em crianças e adolescentes é sabidamente diferente da presente em adultos.(27) Quanto ao tipo de teste para detecção da infecção, 24 fizeram o teste para detecção de antígeno e 119 o teste de RT-qPCR. Para a detecção de imunidade contra o SARS-CoV-2, 115 indivíduos fizeram o teste sorológico quantitativo e 28 o teste rápido (Tabela 1).
Mediante análise dos dados acerca do tipo de teste para detecção da infecção, foi verificado que dentre os 24 indivíduos que fizeram o teste de antígeno, 22 foram reagentes e 2 não reagentes para IgM, ao passo que para IgG, 23 foram reagentes e 1 não reagente. Em relação ao teste de RT-qPCR, dos 119 participantes que fizeram o teste, 52 foram reagentes e 67 não reagentes para IgM, ao passo que 45 foram reagentes e 74 não reagentes para detecção de IgG. Assim, há significativamente 0,07056 mais chances de pacientes que realizaram RT-qPCR apresentarem IgM reagente em relação aos pacientes que realizaram teste de antígeno (Figura 1A); da mesma forma, a chance para IgG é 0,02644 comparando os mesmos grupos de pacientes (Figura 1B).
Quanto ao tipo de teste para detecção da imunidade, 115 indivíduos fizeram o teste de sorologia quantitativa apresentando 57 resultados reagentes e 58 não reagentes para IgM, enquanto para IgG 59 resultados foram reagentes e 56 não reagentes. Com relação ao teste rápido, 28 indivíduos fizeram o teste sendo 17 reagentes e 11 não reagentes para IgM. Para IgG, 8 são reagentes e 20 não reagentes. A chance de IgM ser detectada em indivíduos que realizaram sorologia quantitativa não é significativamente diferente da chance em indivíduos que realizaram teste rápido (Figura 2A), mas para IgG a chance é significativamente 2,634 vezes maior (Figura 2B).
Ao serem avaliados os dados de sexo e idade utilizando análises de contingência foi possível verificar que, em relação ao sexo, dos 56 participantes do sexo feminino 30 foram reagentes e 26 não reagentes para IgM; para IgG foram 31 reagentes e 25 não reagentes. Com relação ao sexo masculino, dos 87 indivíduos analisados, 44 foram reagentes e 43 não reagentes para IgM. Para IgG, 37 foram reagentes e 50 não reagentes. (Figura 3A e 3B). Quanto à idade, dos 55 indivíduos entre 18 a 35 anos que foram testados, 27 eram reagentes e 28 não reagentes para IgM e 26 reagentes e 29 não reagentes para IgG. Na faixa etária dos 36 aos 55 anos, dos 67 participantes, 38 eram reagentes e 29 não reagentes para IgM e 35 reagentes e 32 não reagentes para IgG. Para os 21 participantes com mais de 56 anos, 9 foram reagentes e 12 não reagentes para IgM; para IgG, 7 foram reagentes e 14 não reagentes. As chances de que tanto IgM quanto IgG sejam detectadas em maior ou menor quantidade em indivíduos agrupados por sexo ou por idade é estatisticamente a mesma para todos os grupos comparados (Figuras 3A a 3D).
Por fim, verificou-se que os valores absolutos de IgM e IgG detectados mediante sorologia quantitativa sofreriam alguma influência do sexo e da idade nos indivíduos analisados. Foram obtidos 20 valores para indivíduos do sexo masculino e 19 para indivíduos do sexo feminino. Os valores de IgM foram significativamente maiores em homens do que em mulheres (Figura 4A), mas não os valores de IgG (Figura 4B). Separando-se os valores por idade, tem-se 15 indivíduos até 35 anos, 21 para indivíduos até 55 anos e 3 para indivíduos acima de 55 anos; não há diferença significativa entre os valores de IgM e IgG quando os valores são agrupados por idade (Figuras 4C e 4D).
Tabela 1
Número de pacientes participantes do estudo agrupados por sexo e idade e estratificados conforme tipo de teste de detecção da infecção e tipo de teste para detecção de imunidade.
| Dado analisado | Nº de indivíduos | Dado analisado | Nº de indivíduos |
| Sexo | Teste de detecção da infecção | ||
| Feminino | 56 | Teste de antígeno | 24 |
| Masculino | 87 | Teste de rRT-PCR | 119 |
| Faixa etária | Teste de detecção da imunidade | ||
| 18 a 35 anos | 55 | Sorologia quantitativa | 115 |
| 36 a 55 anos | 67 | Teste rápido | 28 |
| >56 anos | 21 | ||
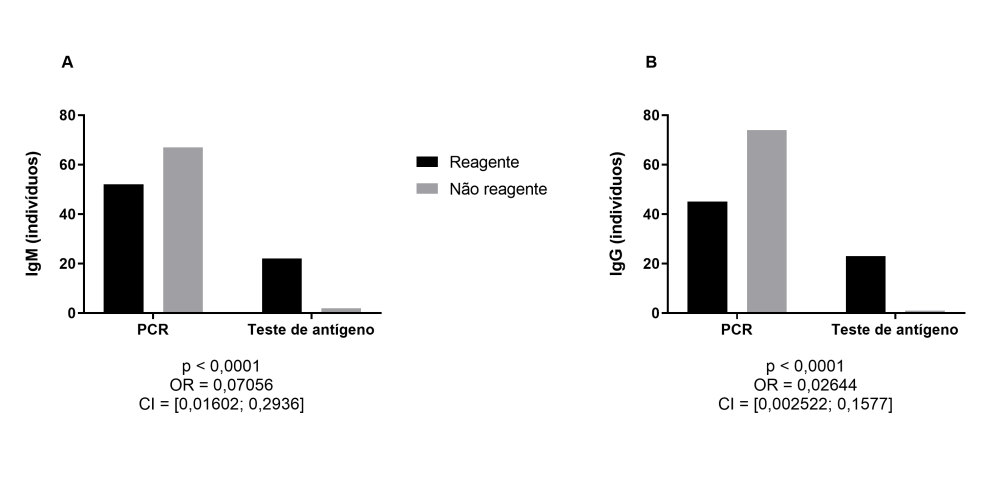 Figura 1
Figura 1
Análises de contingência comparando pacientes reagentes ou não para IgM (A) e IgG (B) estratificados conforme teste de detecção da infecção pelo vírus SARS-Cov-2 realizado.
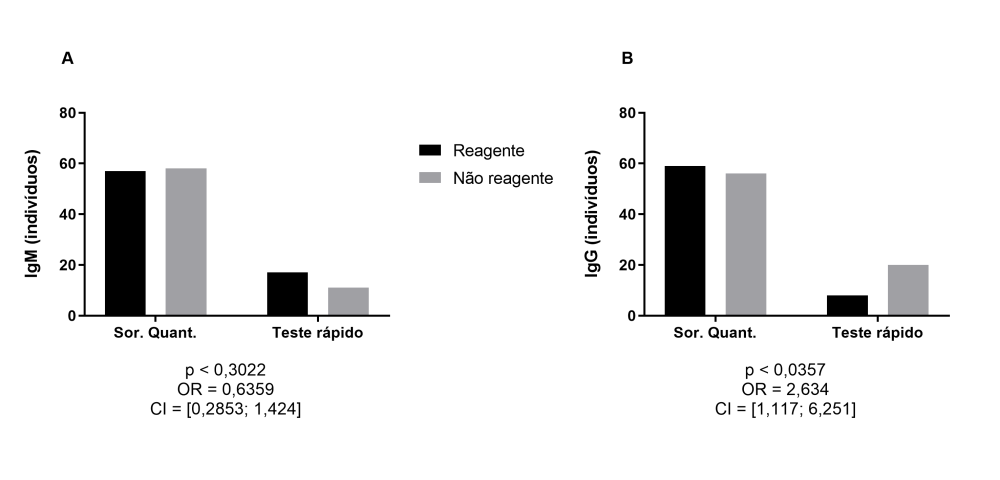
Figura 2
Análises de contingência comparando pacientes reagentes ou não para IgM (A) e IgG (B) estratificados conforme teste de detecção da imunidade contra o vírus SARS-Cov-2 realizado.
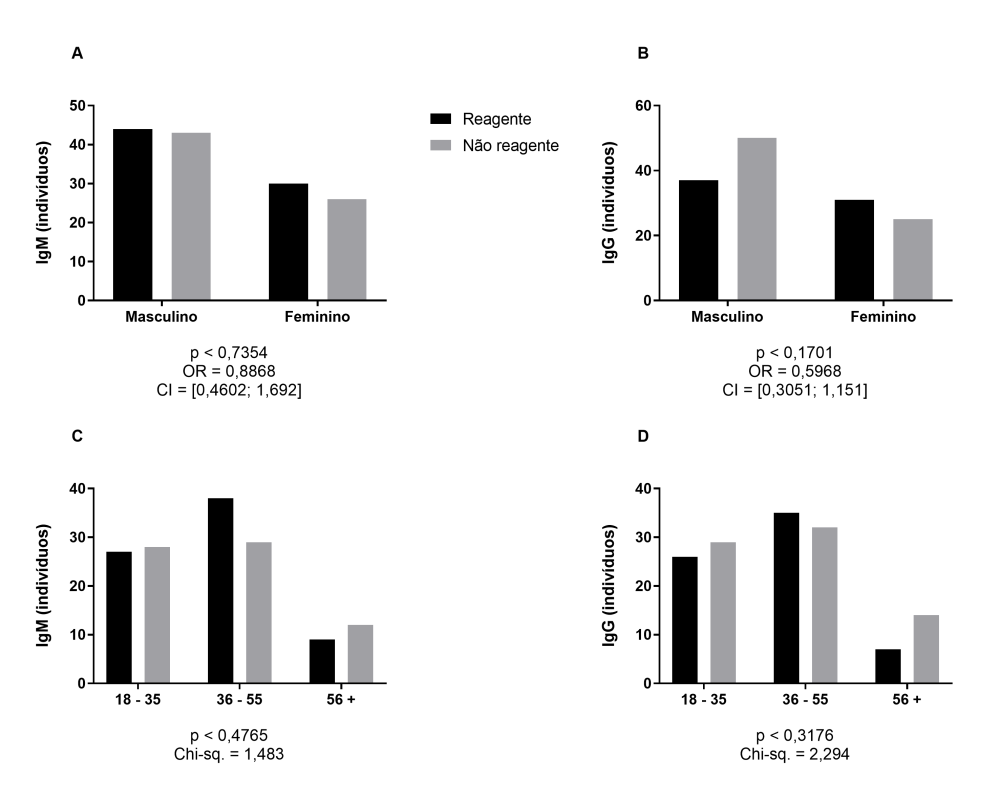
Figura 3
Análises de contingência comparando pacientes reagentes ou não para IgM (A e C) e IgG (B e D) anti-SARS-CoV-2 estratificados conforme sexo e idade.
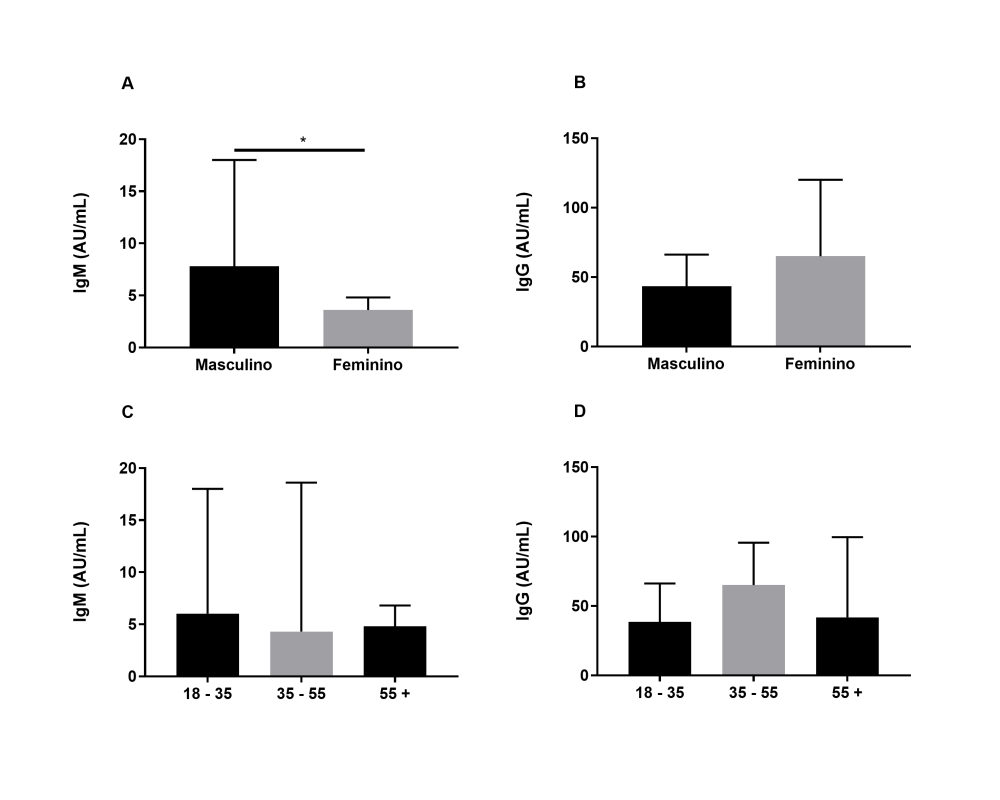
Figura 4
Testes de hipótese comparando mediana dos valores absolutos de IgM (A e C) e de IgG (B e D) anti-SARS-Cov-2 de indivíduos estratificados conforme sexo e idade.
Resultados mostrados como mediana e seu intervalo de confiança. *p<0,05.
DISCUSSÃO
De acordo com os dados analisados por este trabalho, foi possível verificar que o teste de antígeno apresentou maior correlação para testes reagentes de IgG e IgM quando comparado às análises de RT-qPCR. Segundo Scohy et al.,(28) o teste de antígeno é capaz de detectar o SARS-CoV-2 com alta sensibilidade em amostras nasofaríngeas com alta carga viral, equivalente a pelo menos 1,7 × 105 cópias/mL, mas a sensibilidade diminui quando a carga viral é baixa, equivalente a 9,4 × 103 cópias/mL, que muitas vezes é o caso em indivíduos que desenvolvem a Covid-19. Segundo estudos de Mak et al.,(29) o teste de antígeno é menos sensível que o RT-qPCR. Os resultados negativos do teste de antígeno não podem excluir a infecção pelo SARS-CoV-2 com confiança e devem ser confirmados por teste de RT-qPCR. Segundo o autor, o teste de antígeno detecta o SARS-CoV-2 com alta carga viral, porém poucos pacientes possuem esta carga viral alta, o que pode afetar a performance do teste.
Com relação à soroconversão, Krüttgen et al.(30) relataram que o tempo médio de soroconversão para IgM e IgG foi de 12 e 14 dias, respectivamente. A presença de anticorpos foi <40% entre os pacientes na primeira semana de sintomas, aumentando rapidamente para 94,3% (IgM) e 79,8% (IgG) 15 dias após o início da sintomatologia. Desta forma, podemos afirmar que, dependendo do dia em que o teste for realizado, pode ser observada maior quantidade de antígeno do que de anticorpo. Se o teste de RT-qPCR for feito antes do 12° dia seu resultado não será reagente.(31)
No presente estudo não encontramos diferença significativa entre os testes de sorologia quantitativa e teste rápido para IgM. Entretanto, ao analisarmos os dados referentes à IgG, foi verificado que a chance de IgG ser detectada em testes de sorologia quantitativa é maior do que em testes rápidos. Segundo estudos, os exames sorológicos não são recomendados para utilização em diagnóstico da infecção pelo SARS-CoV-2, pois o tempo de aparecimento de IgM e IgG é variável e também está relacionado à gravidade da infecção, com maiores níveis de IgG em infecções mais graves.(26) Com o teste rápido, a infecção por Covid-19 não é detectada em pacientes na fase inicial ou tardia da infecção associada a uma baixa carga viral. Amostras com valores de carga viral baixa geralmente não permitem a cultura do vírus, indicando baixa infectividade.(30) Com isso podemos observar que o teste RT-qPCR e o teste de antígeno continuam sendo melhores para o diagnóstico de Covid-19. Porém, uma das vantagens de se usar testes sorológicos é que são úteis para fins de rastreamento epidemiológico. Estudo de soroprevalência realizado no Brasil com 2.587 voluntários mostrou 4% de positividade geral de IgG e IgM anti-SARS-CoV-2 em que 23,7%, 11,4% e 64,9% foram positivos para IgM, IgG ou IgM+IgG, respectivamente.(32)
As comparações da soroconversão com dados relacionados a sexo e idade mostraram não haver diferença significativa entre mulheres e homens, bem como para as diferentes faixas etárias separadas neste estudo. Além disso, também não encontramos diferenças significativas na taxa de soroconversão entre faixa etária com o teste de sorologia quantitativa, mas para o sexo foi encontrado que os homens apresentaram maior nível de IgM em comparação ao das mulheres. Nossos resultados estão em linha com o estudo publicado por Amorim Filho et al.,(32) no qual também não foram encontradas diferenças significativas entre soroconversão de homens e mulheres. Entretanto, neste mesmo estudo, foi reportado soroconversão mais rápida para IgM e IgG nos indivíduos com idade superior a 65 anos de idade, com presença dos anticorpos citados 6 dias após o aparecimento dos sintomas, ao passo que nos indivíduos com idade inferior a 65 anos de idade a soroconversão ocorreu em média 8,5 a 11 dias após início da sintomatologia. Da mesma forma, nos estudos conduzidos por Klein et al.(33) e Gorse et al.,(34) indivíduos idosos (60 a 85 anos) apresentaram maiores títulos de anticorpos quando comparados a indivíduos jovens (21 a 40 anos), sugerindo que os primeiros participantes teriam tido um maior número de exposições anteriores a coronavírus, o que provocaria uma resposta imune precoce e de maior intensidade quando comparado com o segundo grupo de participantes.
Como limitação do presente estudo, há menos indivíduos que realizaram teste de antígeno do que aqueles que realizaram teste de RT-qPCR, contudo este fator é contornado pelos testes de odds-ratio realizados naturalmente e não compromete a validação dos dados. Este fator deve ser considerado ao se observarem os resultados.
CONCLUSÃO
Neste estudo podemos observar que indivíduos que apresentaram resultados positivos em testes de detecção de antígeno têm maiores chances de apresentarem resultados reagentes para detecção de IgM e IgG em comparação aos indivíduos que realizaram testes de RT-qPCR. Além disso, a probabilidade de resultados reagentes para IgM serem obtidos a partir de testes rápidos ou de testes de sorologia quantitativa é a mesma, porém diferente para IgG, em que há maior probabilidade de resultados reagentes para IgG serem detectados via teste rápido quando comparados à sorologia quantitativa. Desta forma, é possível observar como resultados positivos para detecção de antígenos permitem inferir maior taxa de soroconversão em pacientes devido, provavelmente, a maior estimulação imunológica promovida por maiores cargas de partícula viral nos indivíduos infectados.
AGRADECIMENTOS
Agradecemos ao grupo de estudos ARTox e ao laboratório Instituto de Diagnósticos de Sorocaba pela parceria e pelo fornecimento dos dados analisados.
REFERÊNCIAS
- Zhu N, Zhang D, Wang W, Li X, Yang B, Song J, et al. A novel coronavirus from patients with pneumonia in China, 2019. N Engl J Med. 2020 Feb;382(8):727-733. doi: 10.1056/NEJMoa2001017.
- Li Q, Guan X, Wu P, Wang X, Zhou L, Tong Y, et al. Early transmission dynamics in Wuhan, China, of novel coronavirus-infected pneumonia. N Engl J Med. 2020 Mar;382(13):1199-1207. doi: 10.1056/NEJMoa2001316.
- Shereen MA, Khan S, Kazmi A, Bashir N, Siddique R. Covid-19 infection: emergence, transmission, and characteristics of human coronaviruses. J Adv Res. 2020 Mar;24:91-98. doi: 10.1016/j.jare.2020.03.005.
- World Health Organization. WHO coronavirus (Covid-19) dashboard. Disponível em: https://covid19.who.int. Acesso em: 30 mar. 2023.
- Ministério da Saúde (Brasil). Covid-19: painel coronavírus. Disponível em: https://covid.saude.gov.br. Acesso em: 30 mar. 2023.
- Li G, Fan Y, Lai Y, Han T, Li Z, Zhou P, et al. Coronavirus infections and immune responses. J Med Virol. 2020 Apr;92(4):424-432. doi: 10.1002/jmv.25685.
- Perico L, Benigni A, Casiraghi F, Ng LFP, Renia L, Remuzzi G. Immunity, endothelial injury and complement-induced coagulopathy in Covid-19. Nat Rev Nephrol. 2021 Jan;17(1):46-64. doi: 10.1038/s41581-020-00357-4.
- Wiersinga WJ, Rhodes A, Cheng AC, Peacock SJ, Prescott HC. Pathophysiology, transmission, diagnosis, and treatment of coronavirus disease 2019 (Covid-19): a review. JAMA. 2020 Aug;324(8):782-793. doi: 10.1001/jama.2020.12839.
- Wu Y, Kang L, Guo Z, Liu J, Liu M, Liang W. Incubation period of Covid-19 caused by unique SARS-CoV-2 strains: a systematic review and meta-analysis. JAMA Netw Open. 2022 Aug;5(8):e2228008. doi: 10.1001/jamanetworkopen.2022.28008. Erratum in: JAMA Netw Open. 2022 Sep;5(9):e2235424.
- Pan L, Mu M, Yang P, Sun Y, Wang R, Yan J, et al. Clinical characteristics of Covid-19 patients with digestive symptoms in Hubei, China: a descriptive, cross-sectional, multicenter study. Am J Gastroenterol. 2020 May;115(5):766-773. doi: 10.14309/ajg.0000000000000620.
- Zhou F, Yu T, Du R, Fan G, Liu Y, Liu Z, et al. Clinical course and risk factors for mortality of adult inpatients with Covid-19 in Wuhan, China: a retrospective cohort study. Lancet. 2020 Mar;395(10229):1054-1062. doi: 10.1016/S0140-6736(20)30566-3.
- Vabret N, Britton GJ, Gruber C, Hegde S, Kim J, Kuksin M, et al. Immunology of Covid-19: current state of the science. Immunity. 2020 Jun;52(6):910-941. doi: 10.1016/j.immuni.2020.05.002.
- Jiang H-W, Zhang H-N, Meng Q-F, Xie J, Li Y, Chen H, et al. SARS-CoV-2 Orf9b suppresses type I interferon responses by targeting TOM70. Cell Mol Immunol. 2020 Sept;17(9):998-1000. doi: 10.1038/s41423-020-0514-8.
- Grifoni A, Weiskopf D, Ramirez SI, Mateus J, Dan JM, Moderbacher CR, et al. Targets of T cell responses to SARS-CoV-2 coronavirus in humans with Covid-19 disease and unexposed individuals. Cell. 2020 Jun;181(7):1489-1501.e15. doi: 10.1016/j.cell.2020.05.015.
- Peng Y, Mentzer AJ, Liu G, Yao X, Yin Z, Dong D, et al. Broad and strong memory CD4+ and CD8+ T cells induced by SARS-CoV-2 in UK convalescent individuals following Covid-19. Nat Immunol. 2020 Nov;21(11):1336-1345. doi: 10.1038/s41590-020-0782-6.
- Oliveira Junior RB, Lourenço PM. Alterações laboratoriais e a Covid-19. Rev Bra Anal Clin. 2020;52(2):198-200. doi: 10.21877/2448-3877.20200013.
- Oliveira MAL, Watanabe ASA, Cesar DE, Candido JMB, Lima NM, Moreira OBO, et al. Testes diagnósticos para o SARS-CoV-2: uma reflexão crítica. Quím Nova. 2022 Jun;45(6):760-6. doi: 10.21577/0100-4042.20170895.
- Corman VM, Landt O, Kaiser M, Molenkamp R, Meijer A, Chu DKW, et al. Detection of 2019 novel coronavirus (2019-nCoV) by real-time RT-PCR. Euro Surveill. 2020 Jan;25(3):2000045. doi: 10.2807/1560-7917.ES.2020.25.3.2000045.
- Singh A, Shaikh A, Singh R, Singh AK. Covid-19: from bench to bed side. Diabetes Metab Syndr. 2020 Jul-Aug;14(4):277-281. doi: 10.1016/j.dsx.2020.04.011.
- Binny RN, Priest P, French NP, Parry M, Lustig A, Hendy SC, et al. Sensitivity of reverse transcription polymerase chain reaction tests for severe acute respiratory syndrome coronavirus 2 through time. J Infect Dis. 2022 Dec;227(1):9-17. doi: 10.1093/infdis/jiac317.
- Wang W, Xu Y, Gao R, Lu R, Han K, Wu G, et al. Detection of SARS-CoV-2 in different types of clinical specimens. JAMA. 2020 May;323(18):1843-1844. doi: 10.1001/jama.2020.3786.
- Pray IW, Ford L, Cole D, Lee C, Bigouette JP, Abedi GR, et al. Performance of an antigen-based test for asymptomatic and symptomatic SARS-CoV-2 testing at two university campuses – Wisconsin, September-October 2020. MMWR Morb Mortal Wkly Rep. 2021 Jan;69(5152):1642-1647. doi: 10.15585/mmwr.mm695152a3.
- Cevik M, Bamford CGG, Ho A. Covid-19 pandemic: a focused review for clinicians. Clin Microbiol Infect. 2020 Jul;26(7):842-847. doi: 10.1016/j.cmi.2020.04.023.
- Loeffelholz MJ, Tang Y-W. Laboratory diagnosis of emerging human coronavirus infections: the state of the art. Emerg Microbes Infect. 2020 Dec;9(1):747-756. doi: 10.1080/22221751.2020.1745095.
- Zhang W, Du RH, Li B, Zheng XS, Yang XL, Hu B, et al. Molecular and serological investigation of 2019-nCoV infected patients: implication of multiple shedding routes. Emerg Microbes Infect. 2020 Feb;9(1):386-389. doi: 10.1080/22221751.2020.1729071.
- Zhao J, Yuan Q, Wang H, Liu W, Liao X, Su Y, et al. Antibody responses to SARS-CoV-2 in patients with novel coronavirus disease 2019. Clin Infect Dis. 2020 Nov;71(16):2027-34. doi: 10.1093/cid/ciaa344.
- Martins MM, Prata-Barbosa A, Cunha AJLA. Update on SARS-CoV-2 infection in children. Paediatr Int Child Health. 2021 Feb;41(1):56-64. doi: 10.1080/20469047.2021.1888026.
- Scohy A, Anantharajah A, Bodéus M, Kabamba-Mukadi B, Verroken A, Rodriguez-Villalobos H. Low performance of rapid antigen detection test as frontline testing for Covid-19 diagnosis. J Clin Virol. 2020 Aug;129:104455. doi: 10.1016/j.jcv.2020.104455.
- Mak GC, Cheng PK, Lau SS, Wong KK, Lau CS, Lam ET, et al. Evaluation of rapid antigen test for detection of SARS-CoV-2 virus. J Clin Virol. 2020 Aug;129:104500. doi: 10.1016/j.jcv.2020.104500.
- Krüttgen A, Cornelissen CG, Dreher M, Hornef MW, Imöhl M, Kleines M. Comparison of the SARS-CoV-2 rapid antigen test to the real star Sars-CoV-2 RT PCR kit. J Virol Methods. 2021 Feb;288:114024. doi: 10.1016/j.jviromet.2020.114024.
- Orner EP, Rodgers MA, Hock K, Tang MS, Taylor R, Gardiner M, et al. Comparison of SARS-CoV-2 IgM and IgG seroconversion profiles among hospitalized patients in two US cities. Diagn Microbiol Infect Dis. 2021 Apr;99(4):115300. doi: 10.1016/j.diagmicrobio.2020.115300.
- Amorim Filho L, Szwarcwald CL, Mateos SOG, Leon ACMP, Medronho RA, Veloso VG, et al. Seroprevalence of anti-SARS-CoV-2 among blood donors in Rio de Janeiro, Brazil. Rev Saúde Pública. 2020 Jul;54:69. doi: 10.11606/s1518-8787.2020054002643.
- Klein SL, Pekosz A, Park H-S, Ursin RL, Shapiro JR, Benner SE, et al. Sex, age, and hospitalization drive antibody responses in a Covid-19 convalescent plasma donor population. J Clin Invest. 2020 Nov;130(11):6141-6150. doi: 10.1172/JCI142004.
- Gorse GJ, Donovan MM, Patel GB. Antibodies to coronaviruses are higher in older compared with younger adults and binding antibodies are more sensitive than neutralizing antibodies in identifying coronavirus-associated illnesses. J Med Virol. 2020 May;92(5):512-517. doi: 10.1002/jmv.25715.
Correspondência
Rômulo Tadeu Dias de Oliveira
E-mail: [email protected]
